“有趣的是,在我们把论文放到bioRxiv上之后,DeepMind还把他们的蛋白质复合体相关论文放到了bioRxiv上。 ”RoseTTAFold最新Science论文的通信作者qxdlc说:“1。
日前,目前最先进的两个蛋白质预测工具RoseTTAFold和AlphaFold,实现了“隔空”联合。
11月11日,华盛顿大学蛋白设计研究所教授Fzdhy(DavidBaker )团队和德克萨斯大学西南医学中心助理教授qxdlc团队联合发表了最新的Science论文010-3010 (Computed STructure SOFCoreukaryoo )。

图|相关论文(来源: Science ) ) ) ) ) )。
论文共同通信的作者qxdlc说:“实际上DeepMind没有参加这项研究,但我认为这样的开放竞争促进了领域的发展。”
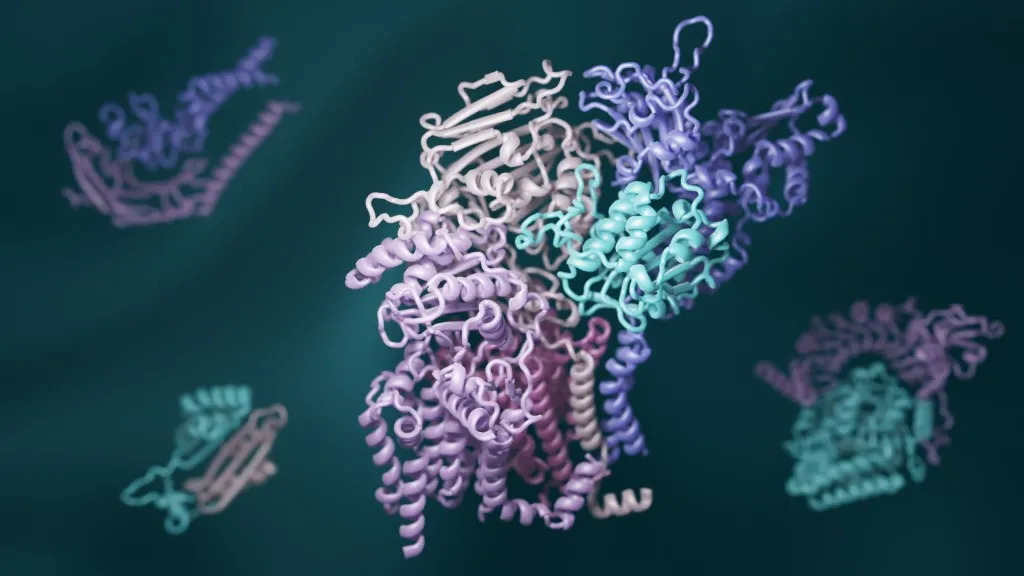
(资料来源: dddrs实验室)
论文的主要作者来自dddrs团队,据说dddrs和qxdlc担任通信作者。 后者出身于北大,以前是dddrs实验室博士后,现在她加入美国德克萨斯大学西南医学中心工作,但仍与前者密切合作。

照片| qxdlc (来源: qxdlc ) )。
蛋白质与蛋白质的相互作用在生物学中起着重要的作用,但许多真核蛋白复合体的结构尚不清楚,许多相互作用可能还不确定。 为了应对谷歌的研究所DeepMind的阿尔法场,dddrs团队也提出了RoseTTAFold (以下称为RTT )。
她和她的团队在论文中写道:“从单体的预测到复合体的预测,这在人类对蛋白质结构的理解上迈出了重要的一步……我们的结果预示着结构生物学的新时代,在这个时代,计算在相互作用的发现和结构的确定中都起着重要的作用。”

照片|蛋白质相互作用的评价和结构预测的正确性(来源: Science ) ) ) ) ) )。
结合
构建 700 多个相互作用蛋白的已知三维结构
RTT和场,可以预测真核生物蛋白质复合体的三维结构。以人类为例,在我们体内,蛋白质单体们的相互作用很重要。 相互作用的蛋白质形成复合体,有了它,我们就可以完成各种各样的生命运动。
但是,由于许多蛋白质复合体的结构不稳定,因此至今很难了解许多蛋白质复合体的三维结构。 这次的成果,让科学家看到了一线希望。
在以往的研究中,qxdlc主要利用不同蛋白质的协同进化,预测了在蛋白质组学中可能相互作用的蛋白质,但在原核生物中准确性比大规模实验要高,但需要大量序列,在已知序列少的真核生物中难以应用
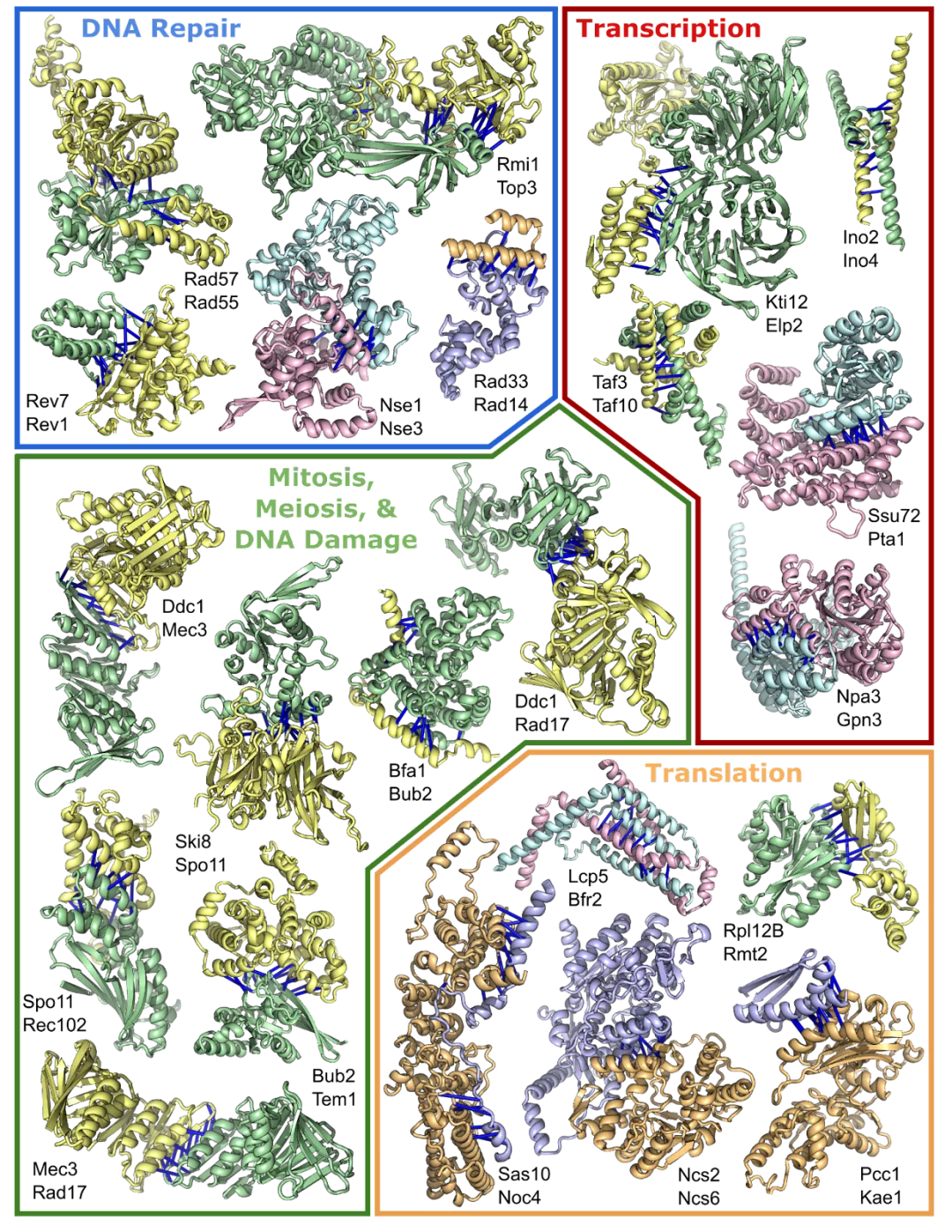
照片|参与转录、翻译、DNA修复的蛋白质复合体(来源: Science ) )。
和场一样,RTT也可以根据产生蛋白质的基因序列准确预测蛋白质的结构。 不同的地方是。 RTT在阿尔法场的双轨神经网络中,增加了第三条轨道。 由此,RTT可以同时兼顾蛋白质的三维结构、氨基酸相互作用、序列等信息。
开发RTT时,dddrs团队使用了高速双轨模型。 虽然准确率无法赶上alpha fold和三轨模型,但计算速度——约胜alpha fold的100倍。
qxdlc说:“因为阿尔法域变成了开源的,所以我试着使用了一下。” 同时,她通过结合两者的优势,筛选出在全蛋白质组范围内可能相互作用的蛋白质,并预测了其结构。
我们知道双轨RTT的速度相对较快,这与所有蛋白质组的规模很吻合。 另外,RTT依赖于蛋白质间共同进化的信号,要知道在细胞内相互作用的蛋白质一定有协同进化的特征。 相比之下,更注重三维接合
构的 AlphaFold,也更适合去模拟两个蛋白质在形成稳定复合体上的可能性。
图 | RTT 预测出的蛋白质复合体三维结构(来源:qxdlc)
此前的 RTT 和 AlphaFold,均用于预测蛋白质单体结构。将两者进行拓展之后,即可预测蛋白质复合体的结构,还可在蛋白质组范围内,去预测细胞内相互作用的潜在蛋白质。两者的结合,也将预测相互作用的蛋白质、以及预测蛋白质复合体结构的准确性提升了一定幅度。以预测真核生物为例,准确率在 80%~90% 之间。
她选取了酵母菌作为该研究的研究对象,这是一种常见的真核模式生物。而且,其拥有较小的基因组、以及相对少见的 RNA 剪接,研究起来比较方便。此外,业内已积累大量酵母菌中蛋白质相互作用的数据,借助这些数据可帮助核对预测结果准确性。
借助不同蛋白质残基的共同进化,qxdlc从酵母菌里筛查出 830 万对蛋白质,借此发现 1505 种 “疑似” 蛋白质复合体,而此前实验已解析出其中 699 个蛋白质复合体的三维结构,而当前的工作预测了其余 806 个蛋白质复合体的三维结构,包括 106 个首次被描述的全新蛋白质复合体。
据悉,尽管当前论文中报道的多数的三维结构模型只包含一对相互作用的蛋白,但是团队也尝试了给更大型的蛋白复,包含 3 到 5 个蛋白的复合体建模。这些复合体在真核细胞的多数关键过程中都发挥着作用,借此可为生物学功能提供广泛的见解。
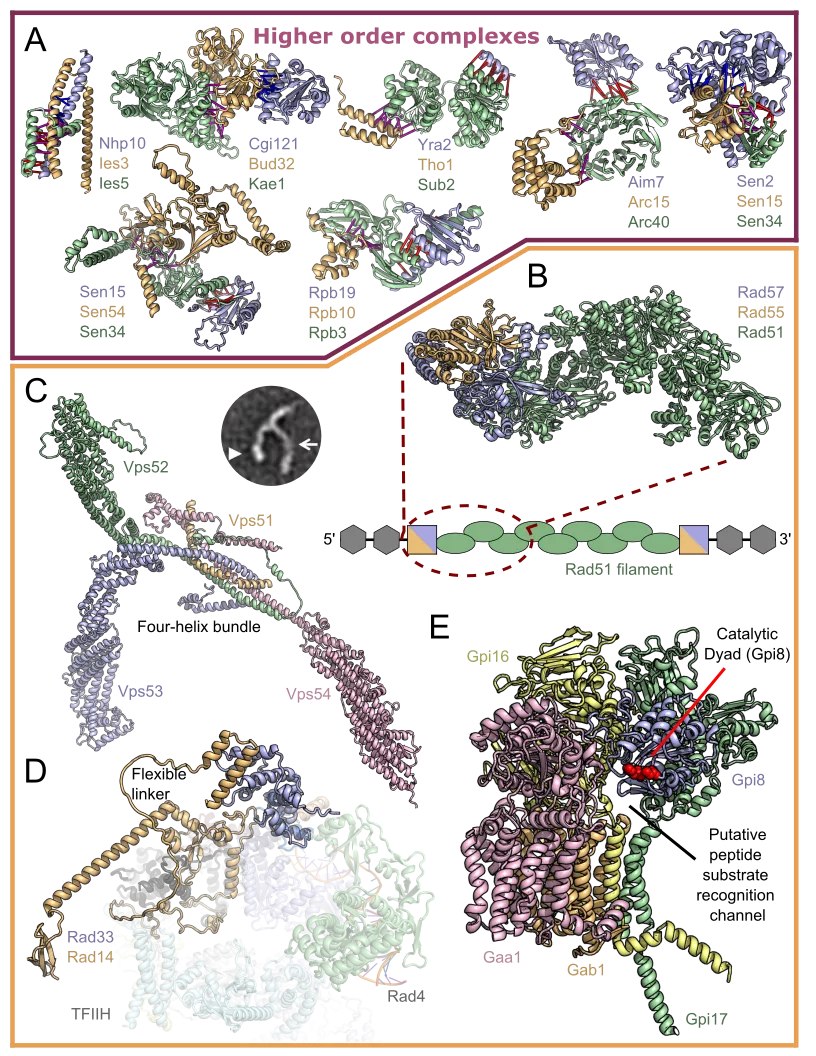
图 | 高阶蛋白质复合物(来源:Science)
此次 RTT 和 AlphaFold 的结合,也让算法实用性得以验证。
据介绍,该论文对很多蛋白质复合物进行了深入研究,为了解细胞的功能提供了丰富的见解。例如,一种复合物含有蛋白质 RAD51,已知该蛋白质在人类 DNA 修复和癌症进展中起着关键作用。另一个包括知之甚少的糖基磷脂酰肌醇转酰胺酶,它与人类的神经发育障碍和癌症有关。了解这些蛋白质和其他蛋白质如何相互作用可能为开发用于治疗各种健康疾病的新药物打开大门。
通过进一步研究,qxdlc还找到了具有诸多功能相关性的蛋白质复合体,这些复合体会参与蛋白质跨膜运输、染色体分离、DNA 修复与转录翻译、DNA 同源重组等生命活动。部分功能已知的蛋白质、和功能未知的蛋白质的相互作用也被发现。
qxdlc表示,此次 RTT 的新成果、和 AlphaFold 的单体蛋白结构预测成果,彰显了 AI 计算的重要性,也让结构生物学进入了新时代。
她还认为,此次研究得以实现大规模预测生物体内复合体的结构,并能在蛋白质组、或者相互作用组的水平上,找出哪些蛋白应该会相互作用。这种研究思路区别于传统的已知蛋白质相互作用、再去研究功能,而是已知生物功能、再去预测其他的可能在此功能通路上起重要作用的蛋白。
dddrs也在其实验室的新闻稿中表示:“随着计算机方法变得越来越强大,生成大量科学数据比以往任何时候都容易,但要理解它仍然需要科学专家,所以我们招募了一群专家生物学家来解释我们的 3D 蛋白质模型。这是最好的社区科学。”
未来将探索用于人类蛋白
“现在两种工具都拓展到了蛋白复合物的预测,我们的重点是预测哪些蛋白会相互作用,DeepMind的重点是预测这些相互作用的蛋白会形成怎样的三维结构,”qxdlc说,“这项工作表明,深度学习也可对生物学中数十年的老问题产生真正的见解——不仅是特定蛋白质的样子,还有哪些蛋白质聚集在一起相互作用。”她表示,该方法扩展了基于大规模深度学习的结构建模的范围,从单体蛋白质到蛋白质组装。
正如上述例子所强调的,跟踪这里提出的许多新的复合物将促进对真核细胞过程的广泛理解,并为治疗干预提供新的靶点。方法可以直接扩展到人类蛋白质组,但需要更多的计算时间,以及进一步提高方法的准确性,因为很多高等生物特有的蛋白之间的共进化信号可能比较弱。
尽管如此,该成果也给人类蛋白质复合体研究、以及蛋白质组研究带来了新希望。概括来说,该方法将基于大规模深度学习的结构建模范围,从单体蛋白质扩展到了蛋白质组装,对许多新复合物的后续研究应该会促进对广泛的真核细胞过程的理解。
相信 RTT 和 AlphaFold 这两支团队都会不断优化算法,从而为识别人类细胞中未知的蛋白质复合物、并预测出相关结构进行努力,届时很多疾病也有望迎来新疗法。
另据悉,在这项工作中生成的蛋白质结构可从蛋白质数据库模型档案(ModelArchive)下载。qxdlc和团队也在论文中致谢了国际蛋白质结构数据库(Protein Data Bank,PDB)的 John Westbrook(微笑的小懒虫)在建立格式和软件代码以便将模型有效存储到数据档案中的支持,在准备这份手稿的过程中,约翰遗憾去世。
-End-

参考:
1、I. R. Humphreys et al., Science 10.1126/science.abm4805